IsoPlexis單細胞功能蛋白(bái)組學揭秘提高NK療法療效的新思路
NK細胞的安全性及其廣譜的抗腫瘤作用,使其被視爲細胞治療界繼CAR-T、TCR-T等的另一(yī)個炙手可熱的當紅炸子雞。NK細胞通過其表面激活受體(tǐ)和抑制受體(tǐ)表達的刺激信号與抑制信号來平衡對靶細胞的應答和耐受。目前對NK細胞激活受體(tǐ)和抑制受體(tǐ)信号傳導的機制仍有待更多的探索和研究,包括通過哪些方法可以促進NK細胞激活受體(tǐ),增強其對抗癌細胞的功能也是目前的研究熱點之一(yī)。
近期發表在Communication Biology的一(yī)篇題目爲Tumor-derived NKG2D ligand sMIC reprograms NK cells to an inflammatory phenotype through CBM signalosome activation的文章通過Isoplexis技術對NK細胞單細胞水平的功能蛋白(bái)質檢測,探索了腫瘤微環境如何通過分(fēn)泌能引發NK細胞産生(shēng)強烈促炎效應的sMIC,實現免疫逃逸。該項研究填補了大(dà)家對NK細胞的抑制性信号通路機制理解的空白(bái),并提出了避免抑制性信号通路導緻的腫瘤免疫逃逸的可行方案。
NKG2D是幾乎在所有NK細胞表面都表達的一(yī)類激活性受體(tǐ),通過結合特異性的NKG2D配體(tǐ)發揮激活作用。NKG2D配體(tǐ)通常表達在一(yī)些經曆炎症反應的細胞上,如發生(shēng)癌變或病毒感染的細胞。MIC是一(yī)種表達在癌變早期細胞上的NKG2D配體(tǐ),其與NKG2D受體(tǐ)的相互作用對于NK細胞狀态的影響目前還沒有清楚的認知(zhī)。
文章解讀
在這篇文章中(zhōng)Dhar等研究人員(yuán)探索了存在腫瘤微環境中(zhōng)的可溶性MIC(sMIC)和結合在細胞表面的MIC(mMIC)對NK細胞功能影響的機制。有研究表明sMIC會下(xià)調NKG2D表達,降低NK細胞的細胞毒功能。該研究團隊通過多組學分(fēn)析發現sMIC的存在會使NK細胞在轉錄組水平出現與炎症、促腫瘤生(shēng)長的細胞因子和趨化因子,如IL-10,CCL1,CCL3的基因的富集。而與細胞毒功能相關的基因則發生(shēng)了下(xià)調。
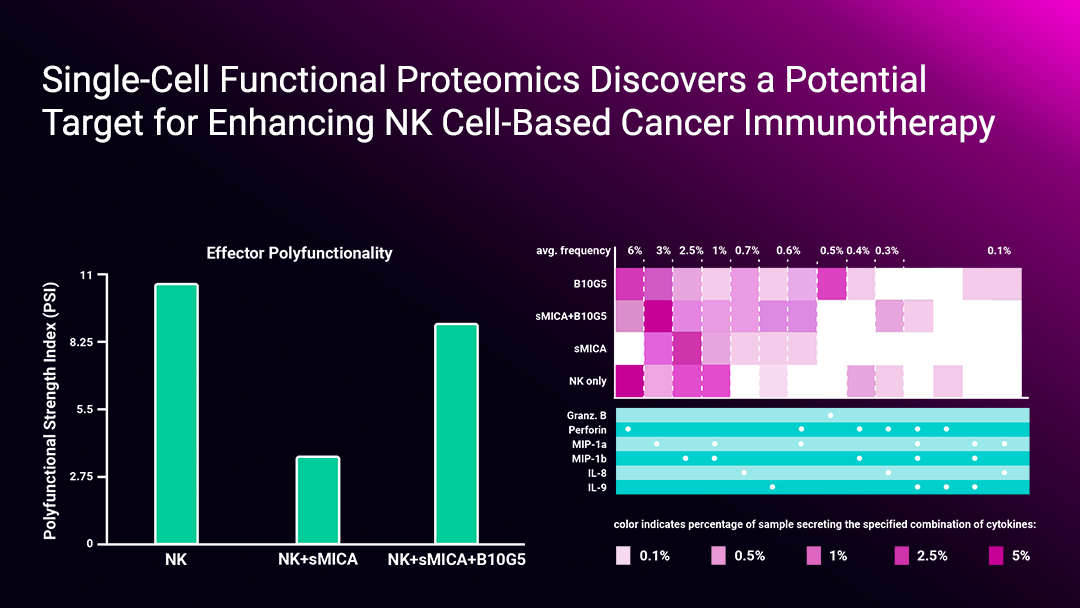
作者通過IsoPlexis的單細胞功能蛋白(bái)組學技術檢測了NK細胞的多功能性。發現與sMIC共培養後,NK細胞的多功能性顯著降低,同時與細胞毒功能相關的效應細胞因子的分(fēn)泌也顯著減少。在使用一(yī)種可以特異性清除sMIC的抗體(tǐ)後,則可以消除sMIC導緻的這種多功能性降低及細胞毒性細胞因子減少的效應。由此作者推斷sMIC通過CBM複合體(tǐ)信号通路調節NK細胞的細胞毒功能,且sMIC可以降低NK細胞的多功能性。
與此相反,mMIC并不會降低NK細胞的功能。作者通過殺傷試驗和免疫印迹試驗都證實NK細胞與表達mMIC的腫瘤細胞共培養後都表現出增強的腫瘤殺傷活性。
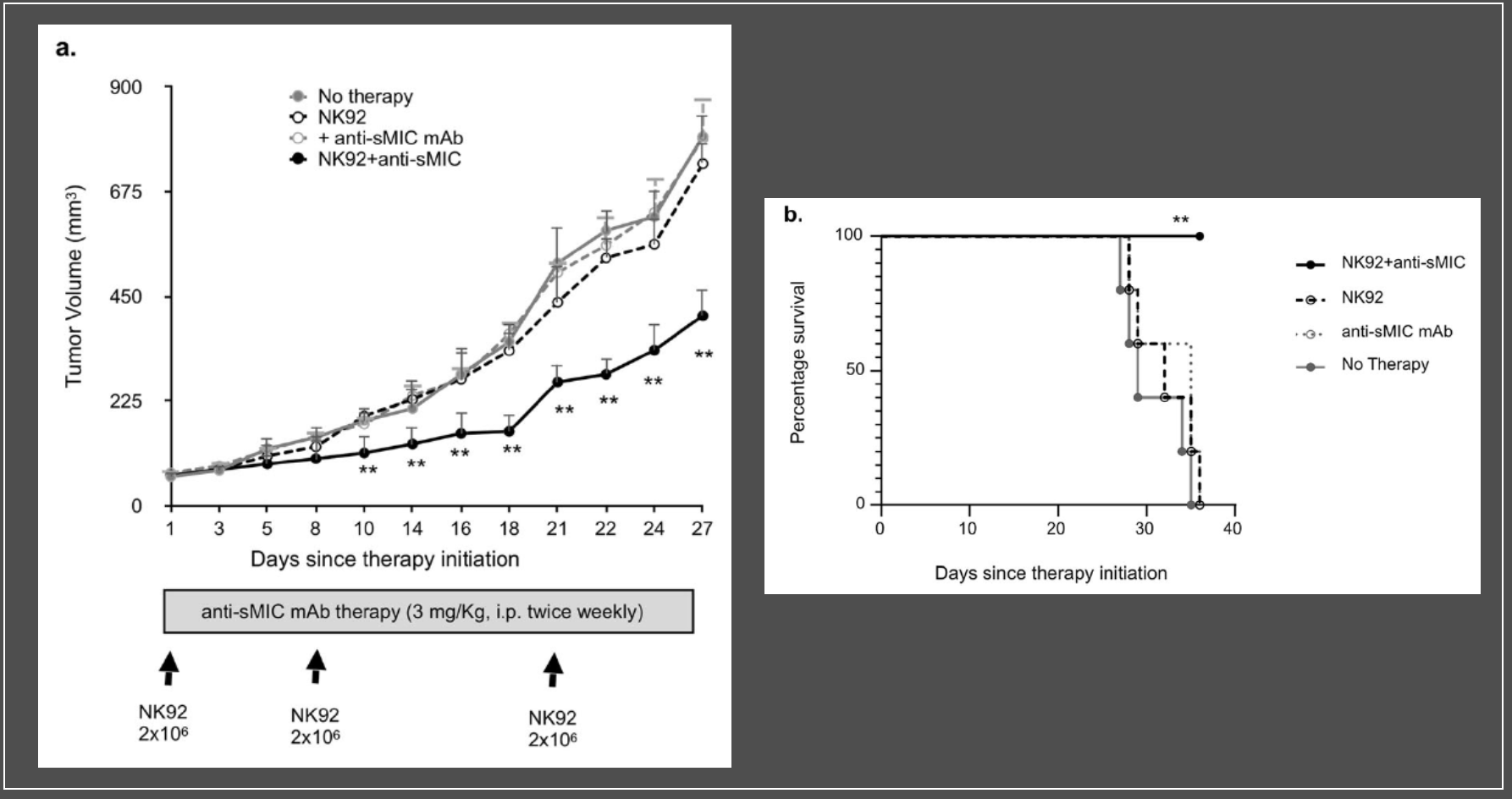
緊接着作者通過一(yī)個移植瘤小(xiǎo)鼠模型對這個體(tǐ)外(wài)的發現進行了體(tǐ)内實驗的驗證。将既表達sMIC,又(yòu)表達mMIC的胰腺癌細胞移植給小(xiǎo)鼠,然後給予小(xiǎo)鼠NK細胞治療。小(xiǎo)鼠腫瘤病竈并未因NK細胞的治療得到有效清除,反而增大(dà),且因疾病進展而發生(shēng)死亡;但給予NK細胞治療同時給予小(xiǎo)鼠抗sMIC抗體(tǐ)治療時,小(xiǎo)鼠腫瘤病竈則得到顯著的清除并獲得更好的生(shēng)存,這與體(tǐ)外(wài)試驗得結論是一(yī)緻。
該研究讓大(dà)家對于促進腫瘤生(shēng)長和疾病進展的NK細胞促炎反應的機制有了更深入的認識。 能更深入地了解由刺激信号和抑制信号共同平衡調節的NK細胞的抗腫瘤效應,以及由抑制信号介導的促腫瘤效應如何可以被消除掉。對于目前開(kāi)展的一(yī)系列NK或CAR-NK療法的研發具有重要的指導意義。IsoPlexis技術從單細胞維度驗證了sMIC對NK細胞免疫應答功能的影響,對于研究NK細胞激活受體(tǐ)和抑制受體(tǐ)信号傳導的機制是非常有幫助的。

如果感興趣的話(huà),掃描下(xià)方二維碼即可下(xià)載原文哦~